UDI合规赋码,企业在实施UDI中的四个关键步骤 !
发布时间:2022年09月15日
2021年9月17日,国家药监局、国家卫生健康委、国家医保局联合发布《关于做好第二批实施医疗器械唯一标识工作的公告》(以下简称《公告》)。《公告》明确,在第一批实施医疗器械唯一标识(UDI)的9大类69个品种基础上,将其余第三类医疗器械(含体外诊断试剂)纳入第二批实施UDI范围。2022年6月1日起,生产的第二批实施UDI的品种应当具有医疗器械UDI。
很多三类器械企业已经在实施UDI项目,其中,UDI合规赋码是UDI实施流程中的难点,对于企业来说,产品标识的UDI信息如果不合规,会面临产品无法流通的困境。或者标识虽然合规,但是赋码设备选型、标识设计及审核、抽检留样,打印记录查询、等实施细节是否符合质量管理要求。要想完成合规的UDI赋码,就需要做赋码设备选型、标识设计及审核、抽检留样,打印记录查询等四个关键步骤:一、选择正确的UDI 赋码设备
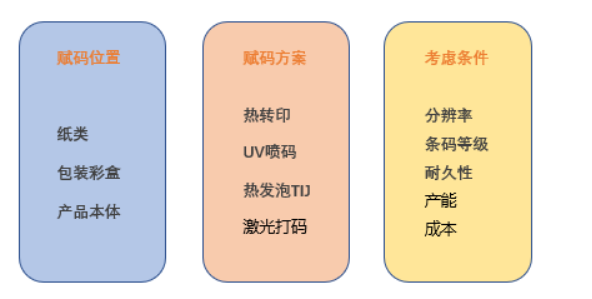
作为 UDI 赋码的载体,需要根据不同的包装材质,来选择不同的的赋码设备,目前市场上的 UDI 赋码设备有热转印打印机,UV喷码机、热发泡TIJ喷码机,激光打印机等,基本满足不同客户不同材质的赋码要求。
UDI常见的包材和赋码方式:
二、标识设计及审核对企业而言,UDI标识的设计需要根据不同的客户要求及法规要求进行标识设计,原先的操作方式是通过人员对于模版的修改进行不同产品不同批次的生产打印,容易出现选错模版打错标签的情况发生,应该按照GMP药品质量管理规范的要求,对标识的设计,审核进行流程上的细化并形成SOP标准操作文档。
标识设计时也需要考虑几个因素:(1)UDI标签上不但要有条码信息,还要有标识说明;(2)UDI条码质量要符合 ISO15415 、15416标准的 C 级以上;(3)UDI条码需要与扫码结果内容保持一致;
(4)UDI条码需要符合 AIDC 与和HRI 原则,包含机器识读及人工识读部分。
三、UDI 标识的抽检留样器械生产企业质量部应当建立质量控制程序,规定产品检验部门、人员、操作等要求,并规定检验仪器和设备的使用、校准等要求。产品标识的抽检留样是质量管理规范的要求,需要对生产过程中的产品标识进行首检,抽检和尾检,并提供条码等级检测报告做为抽检留样的凭证保存下来。· UDI 载体除应符合标签相关质量要求外,还应按如下标准进行检测,条码等级的检测结果应在 C 级以上;
· 一维码:采用GB/T 14258-2003 信息技术 自动识别与数据采集技术 条码符号印制质量的标准进行检测;
· 二维码:采用GB/T 23704-2017 二维条码符号印制质量的标准进行检测。
四、UDI 打印记录查询对于生产过程中的打印数据应当按照生产工艺规程组织注册检验用产品、临床试验产品生产,并如实填写批生产记录。批生产记录应当准确、完整且可追溯。如果您的企业在UDI实施过程中遇到了类似的UDI实施难题,可来上海敖维-UDI数据服务平台获取更多的UDI合规、UDI实施等方面的方案。
UDI数据服务:提供UDI数据服务、招采前、招采后数据服务。UDI咨询合规服务:国内法规咨询-GS1申请注册服务、NMPA数据审核上传咨询服务、UDI合规编码指导等服务;
FDA法规咨询-FDA注册/代理人服务、FDA-510K申报服务、UDI合规编码指导等服务;
CE法规咨询-CE欧代申报服务、CE-PPE个人防护认证服务、UDI合规编码指导等服务。
UDI软件合规服务:提供UDI标签设计软件,医疗器械唯一标识管理系统,打通药监局申报、发码机构编码、追溯应用全流程。轻松实现注册证管理、产品管理、生产管理、基础管理、系统管理。还可提供药监、医保接口服务。
UDI硬件合规服务:提供在线等级检测标签机、条码检测仪、自动喷码机、彩色标签打印机等UDI硬件设备,为医械产品提供切实可行的UDI赋码及等级检测方案。UDI标签合规服务:提供适用一类、二类和三类医械企业的各种医疗设备、IVD(体外诊断)、高值耗材、低值耗材标签材料。
敖维科技承诺5-10个工作日帮助企业完成全套UDI申报,如您有相关UDI合规需求,欢迎咨询021-51699869~





